原文标题:Cytokinetics公司宣布在AAN年会上介绍Reldesemtiv治疗ALS患者2期临床试验FORTITUDE-ALS的结果
2 w! C7 ?8 y; Q0 h
主要有效性分析显示试验没有达到统计显著性
Reldesemtiv所有剂量组患者的SVC和ALSFRS-R下降(幅度)均小于安慰剂组患者,随时间推移出现临床上有意义的差异
各治疗组早期停药和严重不良事件的发生率相似
q# Y3 f" S/ ^
加州南旧金山,2019年5月5日——Cytokinetics公司(Cytokinetics,Incorporated)今日宣布:领导研究员、巴罗神经学研究所神经病学教授兼主席、亚利桑那大学神经病学教授兼执行主席Jeremy Shefner博士在费城美国神经病学学会(AAN)年会上介绍了Reldesemtiv(之前称为CK-2127107)治疗ALS患者2期临床试验FORTITUDE-ALS的结果。
" N D9 ~+ @8 `& D8 g' N" B6 l
对于其主要终点(12周治疗后,缓慢肺活量(SVC)预测百分比从基线的改变)中预先规定的剂量-应答关系没有达到统计显著性(p=0.11)。ALSFRS-R和肌肉力量Mega评分(Muscle Strength Mega-Score)斜率的相似分析得出的p值分别为0.09和0.31。不过,reldsemtiv所有剂量组患者的SVC和ALSFRS-R下降(幅度)均小于安慰剂组,随时间推移出现更大的和临床上有意义的差异。
8 U; r7 y. O$ A3 D( e2 x
虽然对主要和次要终点的剂量-应答分析在0.05的水平上没有达到统计显著性,但在合并剂量的事后分析中,接受reldesemtiv治疗的患者比接受安慰剂治疗的患者下降得更少。该试验显示出在不同剂量水平和时间点上有利于reldsemtiv的效果,12周时观察到的对主要和次要终点的效果是临床上有意义的。治疗12周后观察到的reldesemtiv和安慰剂之间在SVC和ALSFRS-R总分方面的差异,在最后一次给药4周后的随访中仍然明显。
5 C2 j" b2 f3 _. h
FORTITUDE-ALS中安慰剂组和治疗组之间早期停药、严重不良事件和临床不良事件的发生率相似。最常见的临床不良反应包括疲劳、恶心和头痛。安慰剂组患者早期终止试验的主要原因是疾病进行性(发展);reldesemtiv治疗组患者早期终止试验的主要原因是基于胱抑素C(cystatin C)估计的肾小球滤过率(eGFR)下降,eGFR是一种衡量肾功能的指标。转氨酶升高和胱抑素C eGFR下降与剂量有关。
: e' X$ ^' y9 m. v
“来自FORTITUDE-ALS的结果是我们看到的2期ALS临床试验中最令人印象深刻的之一,” Shefner博士说,“尤其值得注意的是,各治疗组观察到的对临床上有意义的终点的效果,具有一致性和持久性。”
! c ]* d, O* }7 C' c6 s
与安斯泰来制药公司(Astellas Pharma Inc.)合作,Cytokinetics公司正在开发reldesemtiv——一种新一代快速骨骼肌肌钙蛋白激活剂(FSTA)——作为衰弱性疾病以及骨骼肌无力和/或疲劳相关疾病患者的潜在疗法。
4 S7 E0 A" z6 d
主要有效性终点和额外分析
- V, V, S. M1 M' C0 j2 W1 L5 }
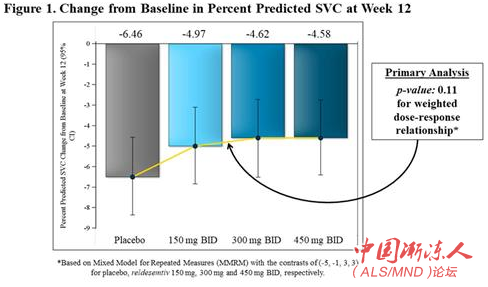
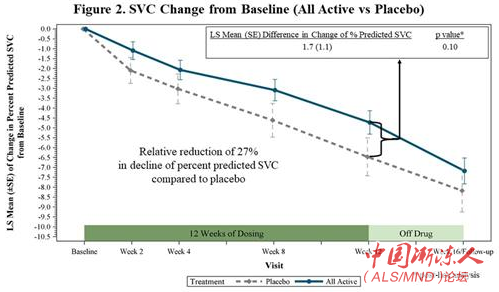
在FORTITUDE-ALS中,对SVC预测百分比从基线到12周改变的主要分析使用一种重复测量的混合模型(MMRM),以分别反映安慰剂、150毫克、300毫克和450毫克reldesemtiv剂量组的假定加权剂量-应答关系。虽然与安慰剂相比,所有reldesemtivtiv剂量均显示出SVC数值减少,但混合模型分析不是统计上显著的(p=0.11)(图1)。在事后分析中,当结合所有积极治疗组与安慰剂组比较时,试验显示SVC下降减少了27%(p=0.10)(图2)。
6 E! u# j* D+ ?/ H; p/ T$ s5 _" o; O
) `+ m, q7 C$ O. {
- \( H. @' r! G) h1 G/ D
; z' F4 G: R8 T2 I# w2 O% Z
图2:SVC从基线的改变(所有治疗组vs安慰剂组)
/ g3 e. e0 E& o' U4 o T' {
在FORTITUDE-ALS中,安慰剂组SVC的下降速度比之前试验中观察到的要慢。在12周的试验过程中,预期安慰剂组患者下降约8.0个百分点,实际上下降了6.5个百分点。
- y+ d. L& Y& N- S# b
次要有效性终点:额外分析
* t! c" E6 t* U b8 }$ i
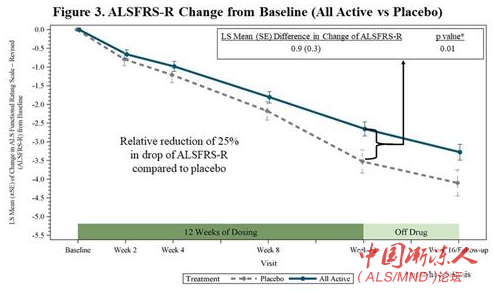
在事后分析中,FORTITUDE-ALS证明当结合所有治疗组与安慰剂组比较时,ALSFRS-R下降减少了25%(p=0.01)(图3)。ALSFRS-R主要测量患者日常生活活动表现,被认为是监管当局接受用于批准药物上市的指标。根据2010年美国东北ALS联盟(NEALS)对ALS临床医生的一项调查,受访者认为,导致ALSFRS-R下降斜率改变20-25%或更高的疗法具有临床上有意义的效果。
: b% W% n5 t Q6 U
7 _$ }( L' r: b
图3:ALSFRS-R从基线的改变(所有治疗组vs安慰剂组)
' _# {* c" e# P% X4 y* S0 r! S
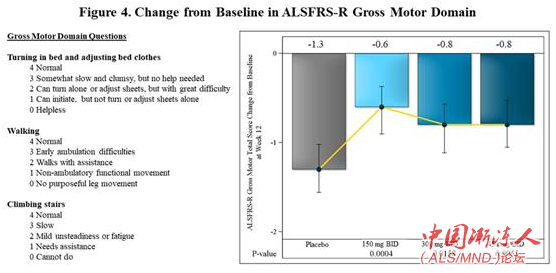
12周治疗后观察到的最大效果表现在ALSFRS-R中测量患者翻身、行走和爬楼梯能力的粗放运动区域(Gross Motor Domain)。与安慰剂组相比,reldesemtiv各剂量组对该区域评分的影响均是统计上显著的(150毫克组p=0.0004;300毫克组p=0.0158;450毫克组p=0.0065)(图4)。
# D4 L% g$ i+ F- z
9 `) K3 Z7 F+ o; `9 [) c! {1 W
8 O s8 F1 T' `
“虽然FORTITUDE-ALS没有达到主要终点,但我们对试验结果感到鼓舞,因为它们进一步验证了骨骼肌激活在治疗ALS患者中的潜力,” Cytokinetics公司研发执行副总裁Fady I. Malik博士说,“这项reldesemtiv的2期试验显示出剂量、终点和时间点方面的一致性效果,我们相信该结果支持reldesemtiv在进一步临床试验中朝着潜在注册的方向发展。”
, G o7 Q P2 F7 H5 X" a0 h
FORTITUDE-ALS:临床试验设计
. j9 l/ ]2 L8 b) c" Q. d7 U
FORTITUDE-ALS是一项reldesemtiv治疗ALS患者的2期、双盲、随机、安慰剂对照、平行组、剂量范围研究。458名来自美国、加拿大、欧洲和澳大利亚中心的合格患者随机(1:1:1:1)接受150毫克、300毫克、450毫克的reldesemtiv或安慰剂治疗,每日两次口服,为期12周。主要有效性终点是12周时SVC预测百分比从基线的改变。次要终点包括reldesemtiv治疗患者肌肉力量(由手持式测力法测量)mega得分从基线的斜率改变;ALSFRS-R得分从基线的改变;治疗突发不良事件(TEAEs)的发生率和严重程度;研究期间reldesemtiv在取样时点的血浆浓度。
" H" U3 ^8 L" P# O9 u
此外,还将测量一些探索性终点,包括reldesemtiv与安慰剂比较对呼吸功能自我评估的效果,由患者在护理者协助下家中自行评估;通过对语言生成特性进行定量测量来评估疾病随时间的发展;通过对书写能力进行定量测量来评估疾病随时间的发展;还将评估reldesemtiv治疗组患者生活质量(由ALSAQ-5测量)从基线的改变。
+ G& d% R# E: H/ s
* W9 P% \- I0 t+ g2 ~! C, A





 发表于 2019-5-8 02:59:42
发表于 2019-5-8 02:59:42

 发表于 2019-5-8 03:28:41
发表于 2019-5-8 03:28:41
 发表于 2019-5-8 09:13:16
发表于 2019-5-8 09:13:16


